皆さん、はじめまして。
科学コミュニケーターの森脇です。
私は今年4月、未来館にやってきました!!なので、ノーベル賞の予想も初めて...。
緊張しますが、坪井の物理学賞の予想、浜口の生理学・医学賞の予想に引き続き、化学賞の予想、第1弾!さっそく予想します!
私の予想は、がん組織の内で起こっている、今日の抗がん剤設計の基本的なコンセプトのひとつとなっている現象を発見した、こちらのお二人です!!!!
(私は去年まで抗がん剤の開発にかかわっていたので、ぜひこの研究を推したかったのです。)
がん治療における高分子薬物の血管透過性・滞留性亢進(EPR)効果の発見

一般財団法人バイオダイナミックス研究所
理事長/研究所長
写真提供:前田浩先生

国立研究開発法人国立がん研究センター
先端医療開発センター医薬品開発グループ
新薬開発分野 分野長
写真提供:松村保広先生
日本人の2人に1人はその生涯の内に、がんを患い、3人に1人はがんによって亡くなっています。今や、誰もがなっておかしくない病気であるがん。
がんについての研究は長年行われていますが、まだ克服できずにいますし、発がんのメカニズムがすべて解明できているわけでもありません。
がんは、研究が進んで1つの謎が解明されると、同時に新たな謎がたくさん出てきてしまうというような、とても複雑で手強い相手だったのです。
そんな複雑ながんですが、かつて、
がん組織に特有のある現象を発見した科学者がいました。その発見は、現在の抗がん剤をつくる上での基本的なコンセプトのひとつとなっています。
そんな素晴らしい研究成果を紹介したい!!!
ということで、EPR効果の発見について紹介します。
EPR効果とは
今回、ご紹介するEPR効果(enhanced permeability and retention effect:血管透過性・滞留性亢進効果)の原理を使うと、抗がん剤を以下のようにできます。どちらも抗がん剤の副作用を減らすために大変に重要なことです。
① 抗がん剤をほぼ狙ったがん組織だけに送り込む
② それもできるだけ長時間にわたって患部にとどまり続ける=大量に投与する必要がない
1980年代当時、抗がん剤はほかの薬と同じく、サイズの小さい(低分子)ものがほとんどでした。
しかし、前田先生と松村先生は、このサイズの小さい抗がん剤と比べて、
サイズが大きい(高分子)抗がん剤の方が、狙ったがん組織に集まり、長い時間とどまり続けるということに気がつき、その現象を「EPR効果」と名付けました。
① なぜ、サイズの大きい抗がん剤は、ほぼ狙ったがん組織にだけ集まるのか
その秘密は、正常な組織と、がん組織の「血管のつくりの違い」にあります。
正常な組織の血管の壁は約5 nm程(1nmは100万分の1ミリ)の極小のすきまが規則正しく並んでいます。一方、がん組織の血管の壁は、正常な組織と異なり、数10 nm~200 nm程の比較的、大きなすき間がたくさんあります。
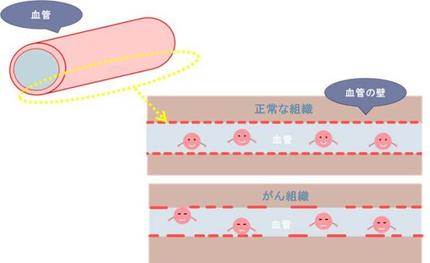
なぜ大きなすき間があるのでしょうか...
がん細胞は、ブレーキが壊れた車のようにアクセル全開で、細胞がどんどん増えていきます。その際、がん組織は必要な栄養を運ばせるために、新しい血管を周囲につくらせるのですが、焦りすぎて、雑で適当な血管を作ってしまうからと考えられています。
この正常な組織と、がん組織の「血管のつくりの違い」によって、サイズの大きい抗がん剤は、ほぼ狙ったがん組織にだけ集まることができるのです。
数10 nm~200 nmくらいのサイズの大きい抗がん剤は、正常な組織の血管から漏れることはありません。なので、身体の中をぐる~と回ってきて、出られるような大きなすき間のあるがん組織に到着したときにだけ、漏れ出る。
これが、狙ったがん組織にだけサイズの大きい抗がん剤が集まってくる仕組みです。
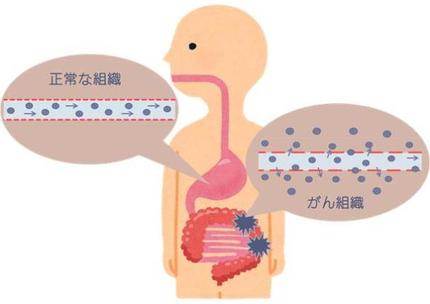
逆に5 nm以下のサイズの小さい抗がん剤だと、正常な組織の血管からも漏れ出てしまいます。つまり...正常な身体の部位や臓器を抗がん剤が誤って攻撃する=副作用になりかねない!!ということです。
② なぜ、サイズの大きい抗がん剤は、がん組織に長時間とどまり続けるのか
血管から出てきたサイズの大きい抗がん剤は、その後どうなるのか。
ここでも、がん組織と正常な組織のある違いが重要なポイントになってきます。
正常な組織では、血管から漏れ出た成分をリンパ系が回収してくれるという機能があります。
しかし、がん組織では、そのリンパ系が上手く働いていません!!なので、一度血管の外に漏れ出たサイズの大きい抗がん剤は、未回収のままそこに長時間とどまり続けることになります。
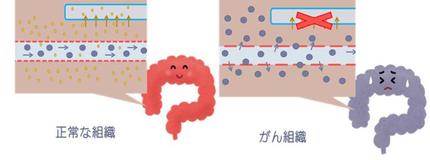
また、サイズの大きい抗がん剤は小さな抗がん剤と比べて重いため、動きが遅いこともポイントです。小さな抗がん剤は、がん組織の血管から漏れ出ても、再び血管の中に素早く戻ってしまいますが、大きなサイズだと、なかなか戻らない。
だから、大きな抗がん剤は、がん組織に長時間とどまり続けるのです。
スマンクスとネオカルチノスタチンとEPR効果の発見
さて、このEPR効果ですが、スマンクスという世界初の高分子型抗がん剤(つまりサイズの大きい抗がん剤)の存在無くしては語れません。
前田先生と松村先生が、初めてEPR効果を報告したのは1986年のことです。「癌化学療法における高分子薬治療の新概念:タンパク質および抗腫瘍薬スマンクスの腫瘍組織親和的蓄積の機序」(日本語は筆者仮訳、文末の参考文献参照)と題したそのときの論文では、このスマンクスというサイズの大きい抗がん剤と、ネオカルノスタチンというサイズの小さい抗がん剤などを使って、がん組織にはEPR効果という現象があることを発見したと報告しました。(ちなみにこの論文では、EPR効果という言葉は出てきていないのですが...)。
この論文では、がん細胞が定着しているマウスに、クロム放射性同位体をラベリングした小さな抗がん剤ネオカルノスタチン、サイズの大きい抗がん剤スマンクス、サイズの大きい生体分子アルブミンなどを投与して体内での動きを見ています。また、血液中のアルブミンとくっつく青い色素を注射して、正常な組織とがん組織におけるアルブミンの動き方の違いを観察しました。その結果、スマンクスやアルブミンなどサイズの大きな分子は、がん組織に集まって長時間とどまり続けることを明らかにしました。また、その理由が、がん組織の特徴(①血管のつくりが粗い②リンパ系が上手く働いていない)によるものではないかと述べています。
スマンクスは、小さな抗がん剤ネオカルノスタチンに、SMA(エステル化スチレン-マレイン酸交互共重合体)という高分子をつないでサイズの大きい抗がん剤にしたものです。
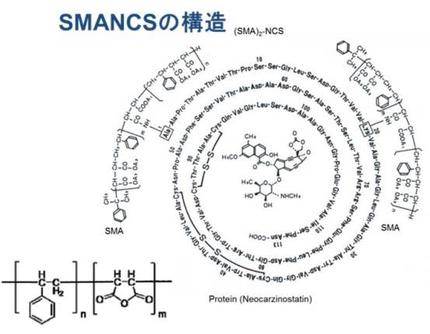
アミノ酸のうずまきの中に入っているのが、ネオカルノスタチンで、
一番外側についている2つの大きなポリマーがSMA。
スマンクスは2012年3月に製造販売中止となりましたが、その基本設計である「既存のサイズの小さい抗がん剤にサイズの大きい分子などをくっつける」研究は世界中で行われています。くっつけるサイズの大きなものにはスマンクスの例のようなポリマーや、タンパク質、リポソーム(脂質の小胞)などがあり、こうしてできた抗がん剤は日本でも、複数が承認されて使われています。
前田先生と松村先生が初めてEPR効果の報告をした論文は、世界中で多くの研究者たちが自分の論文に引用しました。これは、新しい研究分野を作り出したことを意味します。その引用回数の多さから、2016年に「トムソンロイター引用栄誉賞」に選ばれました!!!!世界のがん研究と私たちが受ける医療にいかに大きなインパクトを与えているかが分かります。
まさに、ノーベル賞受賞にふさわしい研究内容と言えるのではないでしょうか。
私情を挟むと...
私のまわりにはがんになった人が何人かいます。なので、がんの発現する仕組みやがんの治療法に非常に興味があります。これまで、がんの発現に関わるタンパク質の研究や、抗がん剤の開発に携わっていた身としては、EPR効果を発見した2人の日本人研究者、
前田先生と松村先生の研究にノーベル賞を!!!!!!
ということで、10月4日のノーベル化学賞の発表が待ち遠しいです...。
参考文献
「A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs」(1986) Cancer Research
2017年ノーベル賞を予想する
生理学・医学賞① コレステロール低下薬 スタチンの発見
生理学・医学賞② 神経科学を変えた!オプトジェネティクス
物理学賞① 300億年に1秒しかずれない究極の時計!
物理学賞② 重力波信号の初キャッチ!そこから何がわかる?
化学賞① がん治療における新たな概念の発見(この記事)
化学賞② 物質最小の動きを見る
化学賞③ プロトン共役電子移動







