皆さんこんにちは!科学コミュニケーターの鈴木です!
2017年のノーベル化学賞、日本人とはいきませんでしたが、私の予想した研究と近い研究が選ばれました!
受賞理由:「溶液中の生体分子を高分解能で構造決定できるクライオ電子顕微鏡法の開発」
● ヨアヒム・フランク (Joachim Frank)
● ジャック・ドゥボシエ (Jacques Dubochet)
● リチャード・ヘンダーソン (Richard Henderson)

先生方、おめでとうございます!
まず、受賞理由にあります「クライオ電子顕微鏡」とは、極低温で使用する電子顕微鏡です。電子顕微鏡というのは、見ようとしているものに電子ビームを当てて原子1つ1つのレベルまで見ることができる機械です。
電子顕微鏡は学校の理科の授業で使う光学顕微鏡よりも、ずっと細かいものを見ることができるものすごい顕微鏡だと思ってください。そして、電子顕微鏡にさらに工夫を重ねたクライオ電子顕微鏡を使うことで私たちの体の中にあるタンパク質やウイルスなどの3次元構造を高画質で見ることができました。そのおかげで体の仕組みや病気の仕組みを解明するのに非常に役立っています。
では、受賞者三人はどのようにこの手法に貢献したのでしょうか。
1.3人は何を発見した?
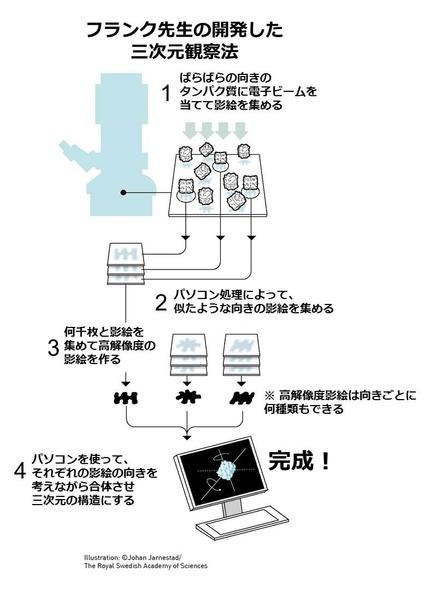
フランク先生は、数学的手法を用いて2次元を3次元に変換した人です!
何を言っているかというと、電子顕微鏡で撮影した写真の変換の話です。電子顕微鏡では影絵のようにものを見ます。この手法では、まず見たいものがいろいろな向きを向いている状態の写真を撮ります。フランク先生はそのたくさんの写真から立体的な形を逆算する計算方法を創り上げました。
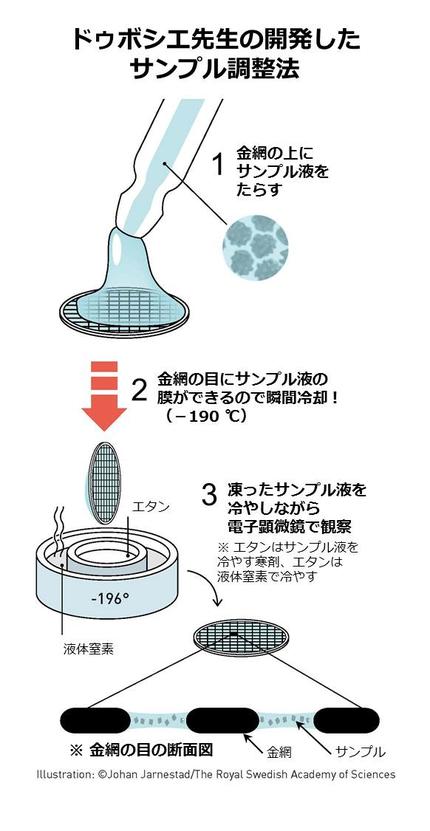
ドゥボシエ先生は、この観察法で使うサンプルを準備する方法を創り上げた人です。
「なんだ、準備だけか」と思われるかもしれませんが、この方法も重要です。クライオ電子顕微鏡の観察では、見たいもののいろんな向きの写真を撮らなければいけません。それには見たいものをたくさん並べないといけません。しかし、電子顕微鏡は影絵なので、見たいもの同士が重なり合ってしまうと台無しです。ドゥボシエ先生はたくさん並べつつ、それぞれが重なり合いにくい方法を創り出しました。
ヘンダーソン先生は、初めてクライオ電子顕微鏡を使って実際に高精細観察を行いました。影絵を重ね合わせることで、難しかったタンパク質の構造解析を簡単に成功させてしまいました。さらに、ヘンダーソン先生はこの方法を使って次々と新しいタンパク質の構造を観察し、クライオ電子顕微鏡観察が生物のタンパク質研究に広く使えることを世の中に示したのです!
2.クライオ電子顕微鏡法で何が見える?
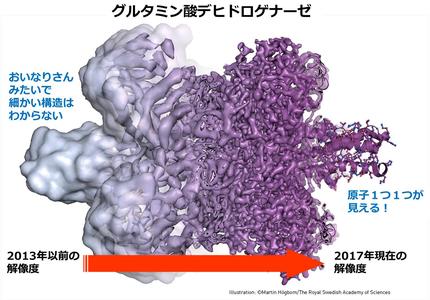
上でも何度か書きましたが、タンパク質の構造が高精細に観察できます!原子1つ1つがどこにあるかわかるほど高精細です!!
......これではあまり腑に落ちないですね。
タンパク質というものは、生き物の体の身体をつくる材料になっているだけでなく、身体の中でいろいろな役目を担っています。たとえば、栄養物質を運んだり、ウイルスと戦ったり──。赤血球にある酸素を運ぶヘモグロビンもタンパク質です。ウイルスや病気をやっつける抗体もタンパク質です。実は、ウイルスそのものもおもな成分はタンパク質です。
これまでタンパク質の構造を見るためには、結晶化させなければいけませんでした。しかし、結晶化にはタンパク質が大量に必要ですし、結晶化させる方法そのものも非常に難しいものでした。
一方、クライオ電子顕微鏡法では、結晶化を必要としません!
しかも結晶化ではタンパク質が体内とは違う形になってしまう恐れがありますが、クライオ電子顕微鏡法では瞬間冷凍することで、体内での状態に近いままの姿を見ることができます!!
つまり、体内で重要な働きをしているタンパク質の多くについて、生体内そのままに近い状態で、簡単に、高分解能の三次元構造を見ることができるわけです。
特に最近、電子顕微鏡の性能が大きく向上したことで原子1つ1つのレベルまで見えるようになり、クライオ電子顕微鏡法はより広く使われるようになってきています!
3.クライオ電子顕微鏡法は何に役立つ?
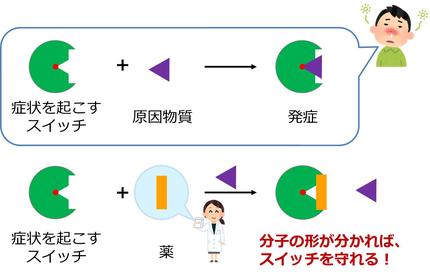
生体内で重要なタンパク質の構造が高解像度でわかるので、生体内でのタンパク質の働きの解明やウイルスに効く薬の開発などに役立てることができます。
私たちの体の中では様々な種類のタンパク質がそれぞれ働いています。酸素を運ぶヘモグロビンやタンパク質の合成をするリボソーム、ウイルスや病原菌と戦う抗体などです。それらのタンパク質の構造が高解像度でわかるということは、私たちは「なぜ生きていられるのか」がわかるわけです。生命現象の実体にせまることができます。
ウイルスの構造がわかれば、ウイルスのどの部分を攻撃する薬を作れば効きそうか、どのような形の薬を作るのが一番効率的か、がわかります。これまでの薬の開発では、偶然に頼ることが多く、様々な形をひたすら作りひたすらウイルスと混ぜ、ひたすら効く形を探すという作業でした。クライオ電子顕微鏡法を使えばこの作業が大幅に短縮できるかもしれません。
4.クライオ電子顕微鏡法はなぜ化学賞?
今まで、「生体」や「タンパク質」、「ウイルス」など生き物に関する言葉が多く出てきました。しかしこれではまるでノーベル生理学・医学賞ではないか、と思われるかもしれません。
ではなぜこの研究がノーベル化学賞なのでしょうか。
ノーベル生理学・医学賞は、私たち生き物の体の仕組みの解明や治療法の開発などに贈られます。一方、ノーベル化学賞は、新しい物質を創り出したり、新しい物質を創る方法の開発などに贈られます。そして時には物質の構造や性質を観察する画期的な方法の開発も選ばれます。
クライオ電子顕微鏡法は、生体内のタンパク質を高分解能で観察することで、「原子1つ1つの配置」のレベルまで形がわかります。原子1つ1つのレベルまで見ることは、化学者が物質の性質を推定し、それを元に新しく物質を創るために必須の情報です。クライオ電子顕微鏡法はまさに化学者が求める観察法であり、物質の構造や性質を見るための画期的かつ強力な方法と言えます。
今年のノーベル化学賞は新しい物質の開発などではありませんでしたが、「物質を見る」という基礎であり重要な方法論が選ばれました。この方法によって生き物の不思議がどこまで解明されるのか、薬の開発がどのくらい加速されるのか非常に楽しみです。私たちの老後は明るいのでしょうか。
ノーベル化学賞は選ばれる対象が本当に幅広く予想が難しいですが、それゆえに新しい視点が得られて非常に楽しませてもらえました。
私が予想した中村栄一先生の研究も、分子1つ1つを原子レベル(くらい)で観察する方法の開発なのでテーマとして非常に近かったのではないでしょうか。惜しかったです。準ノーベル賞です。
最後に改めまして、今回ノーベル化学賞に選ばれましたヨアヒム・フランク先生、ジャック・ドゥボシエ先生、リチャード・ヘンダーソン先生、本当におめでとうございます!!







