改めまして、こんにちは。科学コミュニケーターの若林です。
このブログでは、2024年度のノーベル化学賞の受賞内容に関する概要をお届けした前編に続き、後編としてAlphaFold2のもう少し詳しい原理の解説や、未来館の番組配信における発表の瞬間に関する裏話をお伝えしたいと思います。
AIがタンパク質の構造を予測するってどういうこと?と思った方はもちろん、受賞研究をどのように予想していたのか、発表の瞬間に番組の裏では何が起こっていたのか、気になる方はぜひご一読ください!
そもそも、AlphaFoldは何をしているの?
まずは、タンパク質の構造を予測するAlphaFoldはどんなことができるのか、簡単に見ていきましょう。
ブログの前編では、「アミノ酸の配列が決まれば、タンパク質の立体構造も決まる」という考え方である、アンフィンセンのドグマについてご紹介しました。
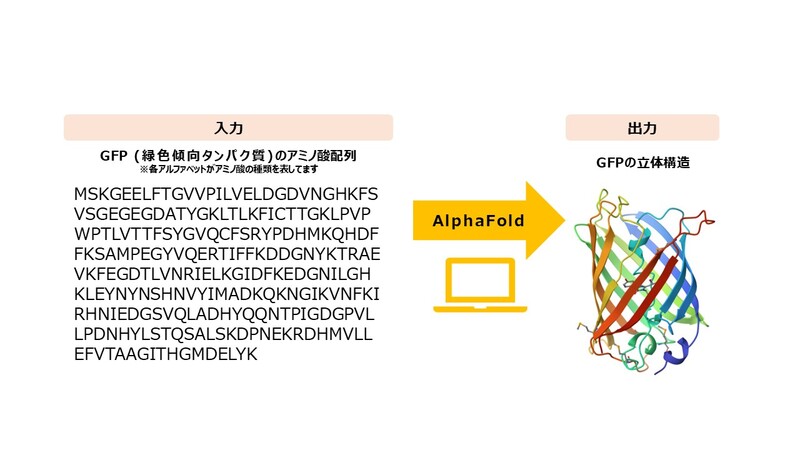
AlphaFoldが行っているのは、まさに「アミノ酸配列からタンパク質の立体構造を決める」ことです。タンパク質を構成するアミノ酸は20種類あり、それぞれアルファベット1文字で表すことができるのですが、コンピューターに入力するのはその並び方だけ。たったこれだけで、アミノ酸でできた「ひも」がどのように折りたたまれるかを予測してくれるのです。
では、どうしてこんなことが可能になるのでしょうか?
AlphaFold2の原理をくわしく解説!
カギとなるのは既存のデータベースとAIの活用
さて、ここからはノーベル化学賞を受賞したAlphaFold2が、どのようにしてタンパク質の構造を予測しているのか、具体的に解説します。
AlphaFold2では、①約2億種類のタンパク質のアミノ酸配列に関する「配列データ」、②約20万種のタンパク質の立体構造に関する「構造データ」、の2種類のデータベースを使用します。これらのデータベースを学習することで、アミノ酸の「ひも」がタンパク質として折りたたまれる際、アミノ酸どうしの位置関係(それぞれのアミノ酸がどのくらい近い位置にあるのか)を計算するのです。
そして、計算されたアミノ酸どうしの位置関係をもとに、最終的にAIがタンパク質の立体構造を予測します。
アミノ酸どうしの位置関係を求めるカギは「共変異」?
では、アミノ酸どうしの位置関係はどのようにして導き出すのでしょうか?
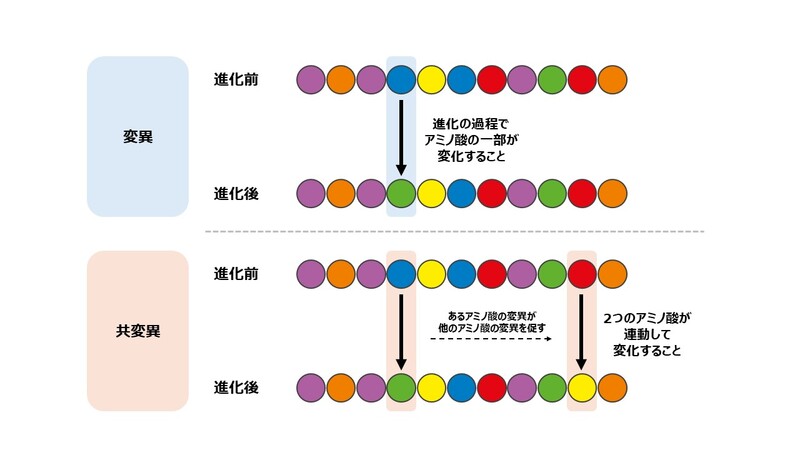
このときに注目するのが、進化の過程で見られるアミノ酸の変化です。実は、生き物の中でつくられるタンパク質のアミノ酸配列は、それぞれの生き物が進化する過程で変わることがあります。そして、あるアミノ酸が別の種類のアミノ酸と入れ替わることを、アミノ酸の「変異」と呼びます。
さらに、この変異があるアミノ酸に対して生じる際、同じ「ひも」の別の部分にあるアミノ酸も連動して変化することがあります。これを「共変異」といいます。
共変異が起こるアミノ酸どうしは、折りたたまれた時に近くにあるといわれています。どうしてかというと、アミノ酸はその種類によって、近くにあると安定しやすい組み合わせがあるからです。例えば、プラスの電荷をもったアミノ酸とマイナスの電荷をもったアミノ酸は互いを引き付け合いますし、水になじみにくい性質を持ったアミノ酸どうしも近くにあると安定します。
このようなアミノ酸のペアの片方に変異が生じると、タンパク質の立体構造の安定性が乱されます。例えば、プラスとマイナスで引き付けあっていたアミノ酸のうち、プラスのアミノ酸がマイナスのアミノ酸に変異したとしましょう。すると、マイナスどうしが反発しあって不安定になり、元の形を保てなくなるイメージです。一方で、プラスとマイナスが入れ替わるようにアミノ酸に共変異が起きれば、安定性は保たれます。
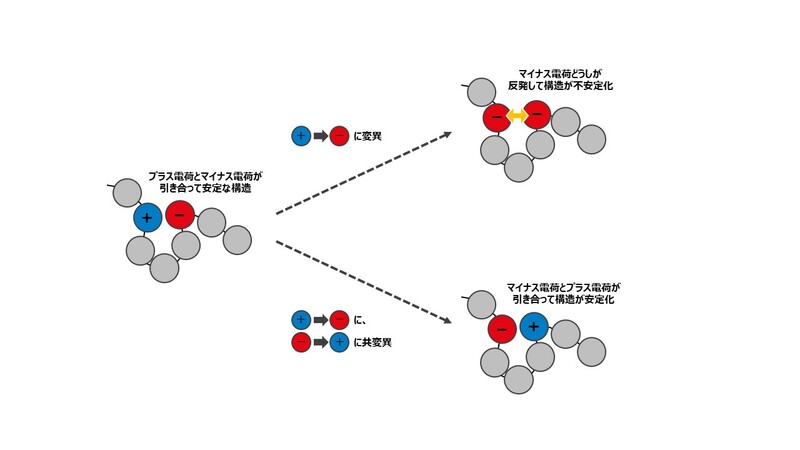
この「共変異したアミノ酸どうしは立体構造の中で近くにある」ということが、タンパク質の立体構造におけるそれぞれのアミノ酸の位置関係を探るカギとなるのです。
データベースを使い、アミノ酸どうしの位置関係をマッピングする
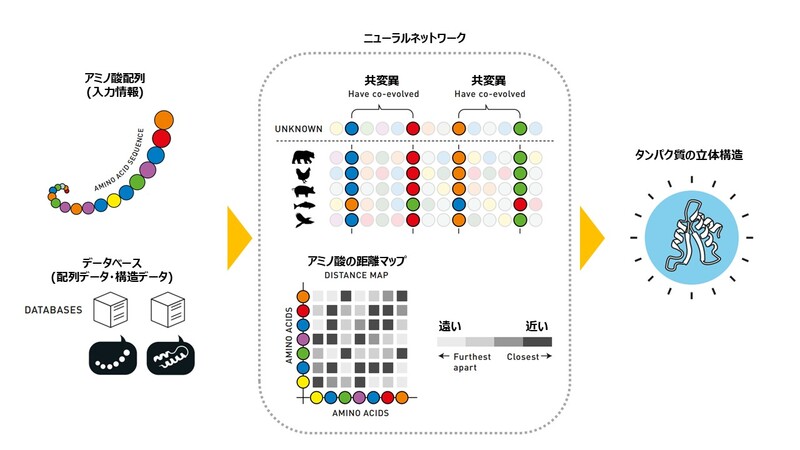
AlphaFold2は、データベースに登録された様々なアミノ酸配列の中から、立体構造を予測したいタンパク質のアミノ酸配列に類似したものを並べ、共変異が起こったと考えられるペアを特定します。このアミノ酸のペアが、折りたたまれた時に近くにくるだろう、と予測するのです。
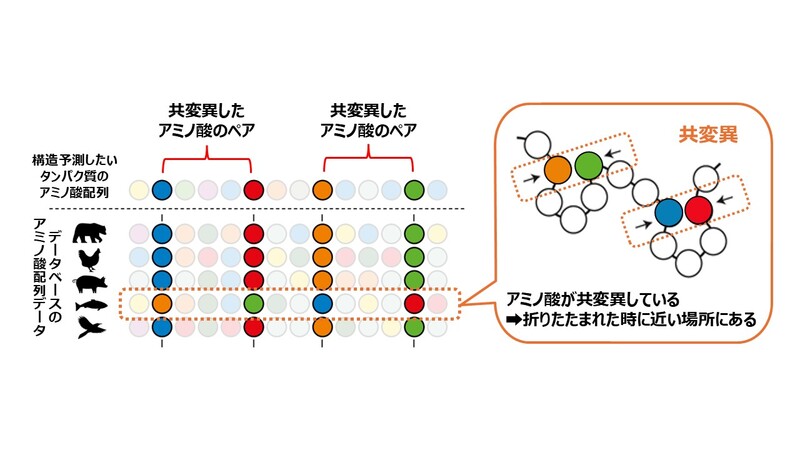
このようなアミノ酸どうしの距離に関する情報が集まったら、これを「距離マップ」にまとめます。これは普通の地図とはちょっと違うのですが、それぞれのアミノ酸どうしがどのくらい近い位置、あるいは遠い位置にあるのかを示したものです。
「距離マップ」では、縦軸と横軸に同じ配列のアミノ酸が並んでおり、この座標上でそれぞれのアミノ酸の交点となる部分の色が、2つのアミノ酸の距離を表しています。この「距離マップ」をつくることで、すべてのアミノ酸の組み合わせに関して立体構造における距離がわかります。
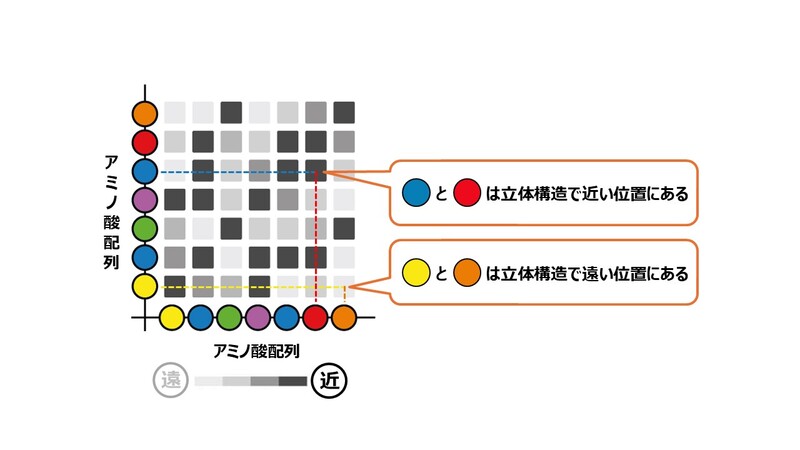
このように、AlphaFold2は共変異の情報からそれぞれのアミノ酸どうしの距離を求め、立体構造におけるそれぞれのアミノ酸の位置関係を調べているというわけです。
正確なだけじゃなく、とにかく速い! 今後の応用にも期待
さて、AlphaFold2のすごいところは構造予測の正確さだけではありません。予測のスピードも非常に速いのです。
番組の配信中にも最新版のAlphaFold3を実際に動かしている映像をノーカットでお届けしましたが、かつて何年もかかることがあったタンパク質の構造決定が、今ではわずか数分程度でできるようになってしまったのです!
このように、素早く正確な構造予測ができるようになったことで、新薬開発などが今後ますます加速することが期待されています。
どうして当たったの? 予想的中の裏話
最後に、裏話を少しだけ。
わたしたちの予想が見事に的中したAlphaFoldのノーベル化学賞受賞ですが、実は「まだ受賞には早いのでは?」という見解も多くありました。ノーベル賞は待ち時間が長いことで知られており、特に近年の成果がすぐに受賞するケースは少ないのです。
では、わたしたちは今年の受賞者をどのように予想していたのか、その裏側を少しご紹介します!
実は、わたしたちが最も注目していたのは「ノーベル化学賞の選考委員」でした。毎回、選考委員の中の誰かが受賞テーマについて詳しい説明を行うため、その年のプレゼンターの分野に近い研究が受賞する可能性が高い、と予測したのです。
では、誰がプレゼンターになりそうかというと……ヨハン・アクビスト氏なのでは、と踏んでおりました。というのも、彼は選考委員を長い間務めているにもかかわらず、これまでプレゼンをしてこなかったからです*。
アクビスト氏のノーベル選考委員としての肩書は理論化学の教授です。しかし、彼には生化学者としての一面もあり、タンパク質関連の研究にも少し関わっているのなら、AlphaFoldという筋も濃厚では……?というのがわたしたちの読みでした。
とはいえ、前日の物理学賞の受賞テーマは機械学習。さすがに2日連続でAIが選ばれることはないかな……と思っていたところに、AlphaFoldが選ばれた!!ということで、発表直後は皆ちょっとだけ驚いておりました。
それにしても、ここまで完璧に的中することはめったにないため、番組配信の終了直後には、まだ切られていなかったマイクから興奮と歓喜の声が漏れまくっていましたね(笑)。

番組はアーカイブでご覧いただけます!
当日見逃してしまった方や、どんな番組だったのか気になる方は、ぜひアーカイブ映像をご覧ください! ニコニコ生放送およびYouTubeでご覧いただけます。
なお、動画での解説は即興解説となってしまったため、ところどころ不正確な部分もございますが、超速報版ということでご容赦くださいませ……!
来年の生配信もお楽しみに!
*参考:Chem₋Station 「SNS予想で盛り上がれ!2024年ノーベル化学賞は誰の手に?」
https://www.chem-station.com/blog/2024/09/nobel2024pre.html (2024年10月17日閲覧)






