こんにちは!ノーベル化学賞チームの森脇です。
今年の化学賞発表まであと1週間をきりました!未来館ノーベル化学賞の予想、第3弾!早速ご紹介します!
私が予想する2018年ノーベル化学賞の受賞者は、
ジョナサン・ロスバーグ(Jonathan M. Rothberg)博士(1963生まれ)。
テーマは「次世代シーケンサーの開発」です。

次世代シーケンサーはDNAの塩基配列を自動、かつ高速で調べることができる装置です。その出現により、医学・生物学の研究は大きく変わりました。患者一人ひとりの体質などにあわせたパーソナル医療や腸内細菌の解析など、新しく登場した分野さえあります。このように研究や私たちの生活を大きく変えた(そして、これからも変え続け得る)次世代シーケンサーの開発。ノーベル賞にふさわしい研究ではないでしょうか!!
ですが、実は、次世代シーケンサーと言っても第2世代、第3世代とあり、それぞれの中にもいくつかのタイプがあります。加えて、どれ1つをとってもその開発には多くの研究者がかかわっています。どの種類のシーケンサーをとりあげるべきか、どの研究者を紹介すべきか・・・。森脇は悩みに悩みました。
だって、どれも素晴らしい貢献で、どれもブレイクスルーだと思えてしまったのです・・・。でも、そんな次世代シーケンサーの開発史の中で、なぜジョナサン・ロスバーグ博士を紹介することにしたのか? それは博士のもたらしたブレイクスルーは、大きな発想の転換によるものだったからです。これから順にお話するのでしばらくお付き合いください。
ゲノム時代の到来、自動でDNA塩基配列を読む装置が登場!!
1990年代、ヒトのすべてのDNAを解読しようという「ヒトゲノム計画」の開始と前後して、さまざまな生物種のゲノムを読むことを目的とした研究計画がアメリカを中心に世界中で始まりました。当時、DNA塩基配列を読む方法として最も使用されていたのは「サンガー法」です。(この方法を開発したフレデリック・サンガーさんは1980年にDNAの塩基配列解読への貢献でノーベル化学賞を受賞しています。ちなみにサンガーさんは、その前にも受賞しており、2度もノーベル化学賞を受賞した唯一のお方です。もしご存命だったら3度目の受賞もあり得た、というのは有名な話ですよね!)
そのサンガー法を自動化し、キャピラリー電気泳動で読む方法(後述)は、
通称・第1世代のシーケンサーと呼ばれています。
「DNA塩基配列の解読を自動化した」ところが大きなブレイクスルーでした。
1990年~2003年に行われていたヒトゲノム計画(ヒトゲノム計画もノーベル生理学・医学賞の受賞にふさわしいと未来館は以前に取りあげています。https://blog.miraikan.jst.go.jp/topics/201309122013-1.html) (リンクは削除されました。また、URLは無効な場合があります。)では、この第1世代のDNAシーケンサーを使っていました。そして、ヒトゲノム計画を実施中の13年間にもさまざまな企業や研究機関が新たな技術を開発し解読のスピードをあげました。
※この過程にも大きなブレイクスルーがあるので本当は紹介したいのですが・・・話し始めたらジョナサン・ロスバーグ博士の功績にたどりつかないので割愛します。もどかしい。
しかし、第1世代のシーケンサーの1日に解読できるDNAの塩基配列は98万塩基が限界でした(機種:ABI3730)。ヒトゲノムの長さは約30億塩基対なので、98万塩基という数の小ささがわかると思います。
量で質を担保~発想の転換がDNAの解読スピードを一気にあげた
2005年、アメリカのバイオベンチャー「454ライフサイエンシズ社」から発売された新たなDNAシーケンサー「454」に世界中の注目が集まりました。
1日に解読できるDNAの塩基配列は約5000万塩基。第1世代のシーケンサーの98万塩基と比べると桁違いに解読スピードが上がっていることがわかります。
つまり、全ヒトゲノムを解析するのに第1世代なら最速でも8.4年かかったところを、「454」なら、たったの1か月で解読することができてしまうのです。これを聞くと、そのスピードのすさまじさを感じてもらえるかと思います。
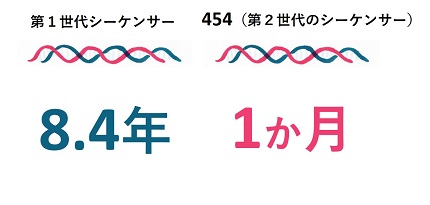
しかも、単純にスピードが速まったとどまらない意味がありました。従来のサンガー法を使用する方法から脱却し、同時に解読するDNAの量を桁違いに増やすことで質を担保するというアプローチが可能になったのです。この新たなシーケンサーは、第2世代のシーケンサーと呼ばれています。
そして、この新たなシーケンサーを開発したのがジョナサン・ロスバーグ博士なのです。
※博士はバイオベンチャー「454ライフサイエンシズ社」を立ち上げた起業家でもあります。
実は、シーケンサーはさらなる改良が進められ、区別するときには第2世代、第3世代......という呼び方をします。ややこしいのですが「次世代シーケンサー」という言葉は、第2世代以降をまとめて使う言葉となっています。
では、どのよう方法で、解読スピードをあげたのか。
第2世代のシーケンサーにはさまざまなタイプがあり解読方法も複数ありますが、ジョナサン・ロスバーグ博士が開発したシーケンサーの解読方法を、従来のサンガー法を使った解読法と比較しながら見ていきましょう。
➀ DNAを断片化する
長いDNAを端からいっぺんに読んでいくのはむずかしいので、まずは短く小分けにします。これは、第1、第2世代共通で必要な工程です。この段階では小分けにしたいろんなDNA断片が混ざった状態です。

② DNA断片を増やす
続いて、断片化された個々のDNAをコピーして増やします。第1世代はPCR法、第2世代はエマルションPCR法を使用して増やしています。
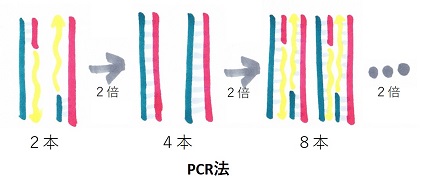
―第1世代・PCR法―
1本のDNA断片だけだと、装置で読み取ることが難しいので、PCRを使いDNA断片を増やしていきます。
ですが、その前に。いろんなDNA断片が混ざっている状態から1つのDNA断片を区別して取り出して増やす必要があります。その時役に立つのが大腸菌。大腸菌を、先ほど用意したいろんなDNA断片が混ざっている溶液を入れてやると、大腸菌1匹1匹は異なるDNA断片をそれぞれ取り込みます。でも、取り込んだDNAを直接大腸菌から取り出すのはこれまた難しいので、いくつかの工程を経て、やっと1つのDNA断片を得ることができます。1つの断片を得るのにかかる日数は大体3日です。
1つのDNA断片を得られたら、いよいよPCRで増やします。PCRは1本のDNA断片を、2倍ずつ、どんどん増やしていく方法です。第1世代のシーケンサーの標準的な装置では、最大で、1度に96個のDNA断片を同時に増やすことができます。
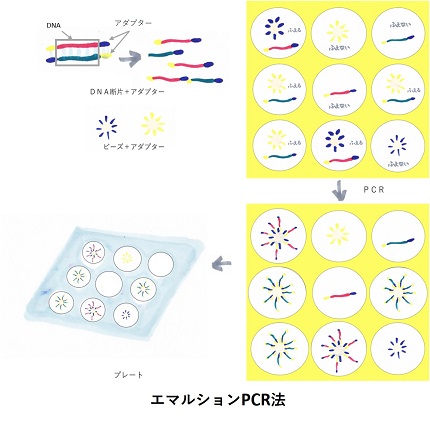
―エマルションPCR法―
一方で、エマルションPCRは、油の中の水滴中にDNA断片とビーズと呼ばれるものを閉じ込めて、DNA断片を増やしていく方法です。1つの水滴中にDNA断片とビーズが1:1の割合で入るようにDNA溶液を十分に希釈して入れるので、第1世代のように、大腸菌を使って1つのDNAを取り出してくる必要はありません。エマルションの水滴の中でPCRにかけて、それぞれのDNA断片を増やした後は、油滴を壊して、プレートと呼ばれるものの穴の中に納めます。初期の第2世代シーケンサーで使われていたプレートの穴は20万個だったので、同時に20万個のDNA断片を増やすことができました。
エマルションPCRは、水滴中で、ビーズに断片がつかなかったり、1つのビーズに2種類以上のDNA断片がついたりしてしまい、目的のDNA断片をうまく増やせないことはあります。しかし、失敗があっても、大腸菌による工程もなく、約20万種のDNAを同時に増やすことができるので、従来のDNAシーケンサーよりも簡単に、そしてスピーディーに1つ1つのDNA断片を増やすことができます。さらにスピーディーにできるので、同じ試料をいくつも用意することもできます。失敗が起きたとしても、同じ試料をいくつも用意すれば、どれが失敗試料かを見極めることができます。
この、
「精度の質は高くないけれど大量のDNA断片を増やすことで解析できるDNA配列の量を増やす」
という発想の転換は、次世代シーケンサー開発の歴史の中での大きなブレイクスルーポイントだと言えます。
③増やしたDNAの塩基配列を読む
第1世代はサンガー法+キャピラリー電気泳動(または電気泳動)、
第2世代の次世代シーケンサーの内、今回ご紹介しているロスバーグ先生が開発された「454」は、パイロシーケンシングを使ってDNAの塩基配列を読みます。
― サンガー法+光る分子+キャピラリー電気泳動―
サンガー法は、DNA断片と、その断片に結合する4種類の塩基をそれぞれ含んだ"DNAの素"を使います。ですが、本物のDNAの素と異なり、この"DNAの素"が取り込まれると、そこでDNAの伸長が止まるように設計されているのです。さらに、この"DNAの素"の塩基部分にはレーザーを当てると光る分子(蛍光色素と言います)もくっついています。塩基の4種類、A(アデニン)、T(チミン)、C(シトシン)、G(グアニン)に合わせて光ったときの色も別々にしてあります。
こうして作成された"DNAの素"配列を、配列を調べたいDNAが入っている溶液に加えて反応させます。
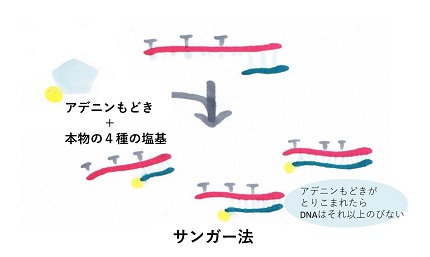
できたさまざまな長さのDNA断片(端には光る分子がついています)をキャピラリーというところに流し、流れてきた順番にレーザーを当てると、光った色によって、塩基がどの順番で並んでいるのかが分かる、という仕組みです。

―パイロシーケンシング―
一方のパイロシーケンシングでは、4種の塩基を含んだ、本物のDNAの素を1種類ずつ順番に加えて反応させます。サンガー法での"DNAの素"とは異なり、これが取り込まれた後にもDNAは伸長できます。同時に取り込まれるときに光(光の色はどれも同じです)を放つように反応液中にしかけがされているので、例えばアデニン(A)を含むDNAの素を流したときに光れば「ここはAが使われる配列だ」とわかり、光らなければ「ここに来るのはAではない」ということがわかります。電気泳動の工程がなく、サンガー法+電気泳動を使っていた第1世代のシーケンサーよりも楽にDNAの塩基配列を読むことができます。
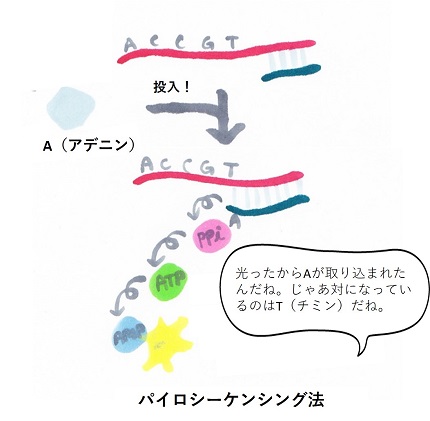
実は、第2世代シーケンサーで登場したエマルションPCR(1,2)もパイロシーケンシング(3)もジョナサン・ロスバーグ博士ではなく別の研究者が考案した技術です。ですが、これら2つの技術をシーケンサーに利用しようと考え、実際に開発したことは偉大な功績と言っていいのではないでしょうか。実際、エマルションPCRやパイロシーケンシングという技術は次世代シーケンサーに利用されていなかったらここまで世界中に普及していないだろうとも言われています。
現在広く使われている第2世代シーケンサー
現在は、1度に解読できるDNAの塩基配列が更に増えた上に、解読コストも下がってきているため、第2世代の次世代シーケンサーは世界中で使用されています。
例えば、Ion Torrent 次世代シーケンサー(Thermo Fisher Scientific社)。

ライフテクノロジーズジャパン株式会社
454とほぼ同じ手法を使っていますが、1度に解読できるのは約10~20億塩基(最新の装置はもっとたくさん読めます)。そしてコストは格段にさがりました。
その秘密は、こちらのチップの中にあります。

秘密その1:こ、こんなところに1200万の穴が...
-------はい、そうなんです!ビーズが固定される穴がチップ上に1200万個あります。
目の形をした部分に1200万個です。
※正しくは、写真のチップのタイプの穴は630万個ですが、Ion Torrent 次世代シーケンサーで使うチップで最も多いタイプが1200万個。
いくつか穴、見えました?(笑)1200万個穴があっても全ての穴にビーズがうまく入るわけではないですし、たまにDNAがきちんと増えていないこともあるので、最終的に読めるのは約600万個分のDNAだそうです。しかし454は穴が全部で20万個だったことを考えると格段に数が増えていることが分かります。ちなみに肉眼で見ることができる穴から4種類の塩基を含む液を順番に出し入れしているそうです。
秘密その2:半導体電極を使ってpHの変化を見る
実は454では、塩基がDNA断片に取り込まれるときに切り離されるピロリン酸と酵素とを反応させた結果生じた化学発光をカメラでとらえていたのです。ですが、Ion Torrent次世代シーケンサーは違います。塩基が取り込まれるときに出てくる水素イオンを半導体電極上のセンサーがとらえることで(pHの変化を見ています)、DNA塩基配列を解読しています。カメラではなく、半導体による検出が可能になったことで大幅なコストダウンが実現した、というわけです。
ここでは、第2世代のシーケンサーをご紹介しましたが、現在は第3世代、第4世代と呼ばれる次世代シーケンサーも登場しています。中には成人男性の親指くらいのサイズのシーケンサーなどもあり、その進歩は今も続いています。
次世代シーケンサーの登場で何が変わった?
DNAシーケンサーの登場で、何が変わったのでしょう? 例えば454を使って解析したものにはマンモスやネアンデルタール人のゲノムなどがあります。化石などからのごく微量の試料からの解析が可能になったのです。ネアンデルタール人のゲノムが解析されたことによって、その遺伝子が現代人にも引き継がれていることが分かり、世界中を驚かせました。私たちの祖先はネアンデルタール人と出会っていたのです。
その他、湖や森の水たまりなどでとってきた水に含まれる微量のDNAを解析し、どのような生物がどのくらいその環境に存在しているのかを調べたり、私たちの腸の中にすむ細菌の種類や割合を調べたりする研究分野に大きく貢献しています(腸内細菌に関しては、山川のブログhttps://blog.miraikan.jst.go.jp/topics/201809132018-9.htmlをご参照ください)。
とりわけ大きな影響を与えているのが、がん医療です。がんは大変複雑な疾患で、例えば肺がん一つを見ても、患者ごとに原因とされる遺伝子変異が異なります。また同じ患者の肺がんに含まれる細胞の中でさえ、異なる遺伝子変異が原因で生じる、性質の異なるがん細胞が存在しているのです。というわけで肺がんという同じ病名のついた患者だったとしても同じ薬が効くとは限りません。これまでの一般的ながん治療では、1つ目の薬が効かなかったら2つ目の薬、2つ目が効かなかったら3つ目・・・という方法が採られていました。
しかし、現在は、患者のがん組織内の多数の遺伝子変異を一度に解読し、原因となっている遺伝子変異を明らかにしてから、その患者に合う薬を選ぶという治療法も少しずつ始まっています。合わない抗がん剤を使うデメリットを減らし、最初から効果的な抗がん剤を選べるようになってきているのです。患者の精神的・肉体的な負担を大きく減らし、医療経済的にもメリットの大きい治療法です。この時、患者のがん細胞の遺伝子変異解析をするのに使われているのも、ここで紹介してきたシーケンサーです。
また前述したとおり、がんは複雑な疾患で、いまだ原因となる遺伝子変異が全て明らかになっているわけではありません。そこで、同じがんを発症している患者たちの遺伝子をたくさん読んで解析することで、レアだけれど、がんの原因となっている遺伝子変異を探し出す研究も進んでいます。この時、遺伝子変異を読むのに使われているのも次世代シーケンサーです。というわけで、次世代シーケンサーは、個人に合わせたがん医療の加速に大きく貢献しています。
ノーベル賞は「人類に貢献」した方に送られます。
2018年ノーベル化学賞は、「ゲノム編集がとるのでは・・・?」と注目が集まっていますが、ゲノム編集という技術もゲノムを読むという技術の上に成り立っています。また、次世代シーケンサーを使った研究によって、上に述べたように私たちの世界観や生活が大きく変わりつつあることを考えたら、今年は「次世代シーケンサーの開発」がノーベル賞を受賞しそう!!と思えてきませんか?ノーベル化学賞は予想が難しいと言われていますが、今年は当てちゃいそうで、森脇は、内心わくわくしています(笑)
今年のノーベル化学賞は10月3日(水)の日本時間18時45分発表予定です!
みなさんもぜひ今年のノーベル賞をお楽しみください!!
【参考文献】
エマルションPCRの開発
1) Nakano M, Komatsu J, Matsuura S, Takashima K, Katsura S, et al. (2003) Single-molecule PCR using water-in-oil emulsion. J Biotechnol 102, 117-124.
2) D Dressman, Yan H, Traverso G, Kinzler KW, Vogelstein B, et al.(2003) Transforming single DNA molecules into fluorescent magnetic particles for detection and enumeration of genetic variations. Proc Natl Acad Sci U S A 100,8817.
パイロシーケンシングの開発
3) Ronaghi.M, et al.(1998)A sequencing Method Based on Real-Time Pyrophosphate.Sience 281,363-365.
454シーケンサー
4) J.M.Rothberg & J.H.Leamon et al. (2008) The development and impact of 454 sequencing. Nature Biotechnology26,1117-1124
その他
Ion Torrent 次世代シーケンサーの原理の分かりやすい動画
・ https://www.youtube.com/watch?v=_apFWLAVtUY (リンクは削除されました。また、URLは無効な場合があります。)
ネアンデルタール人のゲノム解析
・スヴァンテ・ペーボ著(2015)〝ネアンデルタール人は私たちと交配した"文藝春秋
【謝辞】
最後となりましたが、本記事を執筆するにあたりサーモフィッシャーサイエンティフィックライフテクノロジーズジャパン株式会社の橋本裕子様、小野崎登喜郎様に大変お世話になりました。次世代シーケンサーを長年扱っている現場だからこそ分かる感覚や最新の情報など、なかなか聞くことができないお話を伺うことができ貴重な機会となりました。この場をかりて御礼申し上げます。
2018年ノーベル賞を予想する!
生理学・医学賞
その① アミノ酸、足りてますか?あなたの体の栄養分の見張り番
https://blog.miraikan.jst.go.jp/topics/201809102018-4.html (リンクは削除されました。また、URLは無効な場合があります。)
その② 腸内細菌が医療を変える!?
https://blog.miraikan.jst.go.jp/topics/201809132018-9.html (リンクは削除されました。また、URLは無効な場合があります。)
その③ 適応免疫に必須なリンパ球と器官の発見
https://blog.miraikan.jst.go.jp/topics/201809262018-12.html (リンクは削除されました。また、URLは無効な場合があります。)
物理学賞
その① 光を自在に操る人工素材!
https://blog.miraikan.jst.go.jp/event/201809122018-8.html (リンクは削除されました。また、URLは無効な場合があります。)
その② カーボンナノチューブの発見から実用まで(Coming Soon!)
化学賞
その① 脂質なしには成り立たない細胞内シグナル伝達
https://blog.miraikan.jst.go.jp/event/201809052016-14.html (リンクは削除されました。また、URLは無効な場合があります。)
その② ほしいものは折りたたんで作る!DNAオリガミ
https://blog.miraikan.jst.go.jp/topics/201809182018dna.html (リンクは削除されました。また、URLは無効な場合があります。)
その③ 発想の転換でDNA解読の新時代を開く(この記事)
番外編:研究者にとってのノーベル賞
https://blog.miraikan.jst.go.jp/topics/20180919post-824.html (リンクは削除されました。また、URLは無効な場合があります。)







