こんにちは。志水です。
本日は、ノーベル生理学・医学賞の予想、第2弾。
私たち予想チームは、どなたが受賞するか当てにいくだけではなく、今、注目すべき研究をみなさまにご紹介したい!という思いでもこの記事を書いています。
そんなわけで、私、志水がノーベル生理学・医学賞の受賞者として予想するのは、こちらの方です!
大隅 良典(おおすみ よしのり)博士(1945年生まれ)

受賞テーマは、「細胞が自らのタンパク質を分解する『オートファジー』の仕組みの解明」です。
大隅氏曰く、「細胞のなかで、新しくモノがつくられる働きというのは注目を集めやすいが、古いモノを壊す働きはあまり注目されてこなかった」とのこと。しかし、近年さまざまな病気との関連が指摘されていて、今、非常にホットなテーマなのです!
そんな大事な役目を担う「オートファジー」とはいったいどんな働きなのか、早速ご紹介しましょう!
そもそも、細胞ではなぜ古いモノを分解しなければならないのでしょうか?それは、私たちの体が日々生まれ変わっていることに関係があります。
筆者の体で説明しましょう。

筆者(体重70kg)の体のなかでは、毎日約200gのタンパク質が新たにつくられています。これは、細胞のなかで働くタンパク質を新鮮な状態に保つためといえるでしょう。つまり、分子レベルでは、筆者の体は日々生まれ変わっているわけです。
その一方で、筆者が毎日の食事によってとるタンパク質の量は約70g。あれ?計算が合いませんね。材料となるタンパク質は70gしかないのに、体の中では200gのタンパク質がつくられている。残りはどこから来るのでしょう?
実は、細胞のなかにある古いタンパク質を分解し、それを原料にして再びタンパク質をつくる、という一見すると面倒なことをしています。つまり、タンパク質をリサイクルしているのです。

大隅氏の言葉を借りれば、「タンパク質は『壊れる』のではなく、積極的に『壊されている』」のです。日々新しいタンパク質を生み出すために、分解がいかに重要であるかお分かりいただけますでしょうか。
さて、タンパク質を分解する仕組みには、おもに2つの方法があります。「ユビキチン・プロテアソーム系」と「オートファジー」です。それぞれの働きを部屋の掃除に例えてご説明しましょう。
「ユビキチン・プロテアソーム系」は、掃除でいうなら、部屋にあるさまざまな小物のうち、不要になった物に1つ1つ「廃棄」のシールを貼っていき、ゴミ箱に片付けるイメージです。
細胞のなかでこのシールにあたるものが「ユビキチン」という小さな分子です。目印を付けられた不要タンパク質は、プロテアソーム(タンパク質が集まった、かご状のもの)の中に入れられ、切り刻まれます。細胞のなかのゴミを処理する大切な仕組みであることから、「ユビキチン・プロテアソーム系」の研究に対して2004年にノーベル化学賞が贈られています。
一方、「オートファジー」は、掃除に例えると、部屋の一角にある家具やら本やらを、ガバッとすべて大きなゴミ袋に入れるようなやり方でしょうか。
実際の細胞では、大きな袋が現れて、細胞の一部をまるーく囲ってしまうのです。そしてタンパク質を分解する「リソソーム」という小器官と結合し、リソソームに含まれる酵素によってタンパク質が分解されます。つまり、ていねいに1つ1つのタンパク質を見ていくのではなく、細胞の一角にあるタンパク質をまとめて一気に分解します。そんな一見、乱暴に思えるやり方が「オートファジー」なのです。
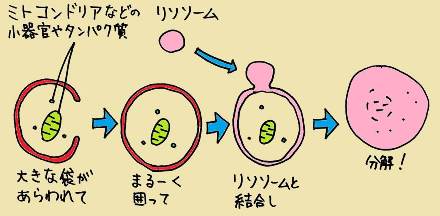
「オートファジー」という働き自体は、動物細胞で起こることが1960年代から知られていました。しかし、その意義や分子的なメカニズムはほとんど分かっていませんでした。
この研究を大きく進めたのが、大隅氏です。1990年代に、大隅氏はオートファジーを引き起こす分子をつぎつぎと特定し、その生理的意義を明らかにする研究の基盤を築いたことで世界的に評価されています。
研究対象に選んだのは、動物細胞ではなく酵母(お酒やパンをつくるときに使われる微生物)です。酵母の遺伝子に傷をつける化学物質を使って、オートファジーが起こらない酵母を人工的につくったのです。そのような酵母をうまく見つけることができれば、傷がついた遺伝子からつくられる分子がオートファジーに関係するとわかりますよね。
この実験、口で言うのは簡単なのですが、実際には大変です。遺伝子に傷をつけた酵母を1つ1つ顕微鏡で観察して、オートファジーが起こらないものを目で見ながら探すのです。大隅氏のグループでは、5000個(!)の酵母をひたすら観察して、たった1個だけ見つけることができました。
その酵母で傷がついていた遺伝子はAPG1と名付けられました(後にATG1に変更)。この遺伝子からつくられるタンパク質は、オートファジーに関係するタンパク質の集合体をかたちづくるために必要であることが現在分かっています。
このように、大隅氏はオートファジーに関係する遺伝子を1つ1つ丹念に明らかにしていった結果、1993年までに14個の遺伝子を見つけることができました。
関係する遺伝子が分かれば、研究は世界中で急速に加速します。なぜなら、遺伝子を壊した生き物を観察すれば、オートファジーがその生き物にとってどのような意義をもつのか、はっきり分かるからです。大隅氏が発見した遺伝子は、酵母以外のさまざまな生物に共通したものでした。私たちヒトをはじめとする哺乳類も、よく似た遺伝子をもっているのです。
現在、オートファジーはさまざまな場面で重要な働きをすることが明らかとなっています。
例えば、生まれてすぐの赤ちゃんが栄養を確保するためには、オートファジーが不可欠です。哺乳類の赤ちゃんが母親の胎内から生まれ出ると、今まで母親とつながっていたへその緒が切れるわけですから、そこで栄養補給は絶たれます。たとえ生まれてすぐお乳を飲んだとしても、消化・吸収するのに時間がかかるので、体は飢えた状態になります。このとき、細胞に含まれるタンパク質を分解することで急場をしのぐわけです。
オートファジーが起こらないようにした赤ちゃんマウスは、生まれてからわずか12時間で死んでしまうといいますから、オートファジーの重要性は明らかです。
また、オートファジーは、細胞のごみを取り除く働きがあることも分かりつつあります。異常なタンパク質や古くなったミトコンドリアという小器官を除去することで、細胞を健康な状態に保っているようなのです。まだ研究の途上ですが、肝臓の腫瘍形成や、脳の神経細胞に異常が起きて生じるパーキンソン病などいくつかの病気にも関わりがある可能性も指摘されています。
オートファジーに関する分野では、これから新しいことがどんどん分かってくるでしょう。その基礎を築いた大隅氏を私はノーベル賞に推薦したいと思います!
参考文献1:「細胞が自分を食べる オートファジーの謎」(水島昇著、PHPサイエンス・ワールド新書)
水島氏は大隅氏とともに研究をしていた方で、現在東京大学でオートファジーの研究をなさっています。記事中にあった、ネズミの赤ちゃんの研究や肝臓の腫瘍形成の研究は、水島氏のグループによるものです。研究室のHPではオートファジーについて詳しく紹介されているので、ぜひご覧ください。
http://www.cellcycle.m.u-tokyo.ac.jp/research/proffessional.html(リンクは削除されました。また、URLは無効な場合があります。)
皆さまも以下のサイトから予想に参加してください!
ノーベル賞を予想しよう!2015(現在は公開を終了)
(リンクは削除されました。また、URLは無効な場合があります。)
2015年ノーベル賞を予想する
生理学・医学賞①免疫制御の分子の発見とがん治療への応用
生理学・医学賞②細胞の中のお掃除係
生理学・医学賞③ゲノムを編集するツールCRISPR/Cas9の開発
生理学・医学賞④ Coming Soon!
物理学賞①電気を通す絶縁体!?
物理学賞②あったぞ!太陽系外惑星
物理学賞③ Coming Soon!
化学賞①モバイル機器の原動力を開発した男たち
化学賞②小さな孔から大きな世界へ
化学賞③縁の下の力持ちDNAマイクロアレイ
化学賞そのほか Coming Soon!
今年もその瞬間をニコニコ生放送で中継します。
ノーベル賞発表の瞬間をみんなで迎えよう







