大隅良典先生、ノーベル生理学・医学賞受賞、
誠におめでとうございます!!

写真:ノーベル財団より。Photo by Mari Honda)
昨年、大隅先生のご研究をブログでご紹介した私、志水も発表を見守っておりました。

大隅先生のご研究は、生物の基本的なしくみに迫るものです。
その研究がこちら!
「オートファジー(自食作用)の仕組みの発見」
(for his discoveries of mechanisms for autophagy)
詫摩の速報でもあったように、オートファジーとは、細胞のなかで不要なものを分解する働きのこと。分解する仕組みはいくつかあるのですが、オートファジーが特徴的なのは、細胞のなかに大きな袋が現れて、袋のなかのタンパク質を丸ごと分解するという点です(近年は、特定のタンパク質を選んで分解するような「選択的オートファジー」も注目されています)。
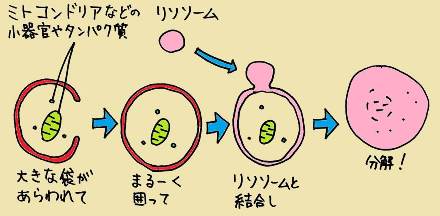
皆さんがお友達やご家族にご説明する場合は、「大掃除」の例えを使うと分かりやすいでしょう。おうちもたまに大掃除しないと不要品がたまってしまうのと同様、細胞の中も不要品がたまると病気の原因になるといわれています。細胞の中では、不要なものに印をつけて不要品を処理する方法(ユビキチン・プロテアソーム系)と、部屋の一角にごみ袋をかぶせて、その中の不要品をまとめて捨ててしまう方法(オートファジー)があります。後者の、一見「断捨離」とも思えるような方法がオートファジーなのです。
大隅先生は、このオートファジーに関わる遺伝子を多数発見し、その遺伝子の働きを明らかにしてきた功績で今年のノーベル生理学・医学賞を受賞されました。
オートファジーの仕組みについては昨年の私のブログをご覧いただくとして、大隅先生がどのようなやり方でオートファジーのご研究をなさったのか、論文をひもときながらご紹介しましょう。
1990年代初頭のこと。当時、動物細胞の中身が分解される仕組みがあることは知られていましたが、どのような仕組みで起こっているのか、まだよく分かっていませんでした。
大隅先生は動物の細胞ではなく、微生物の一種「酵母」に着目しました。酵母は動物細胞と基本的な仕組みが近く、研究対象としてよく使われています。
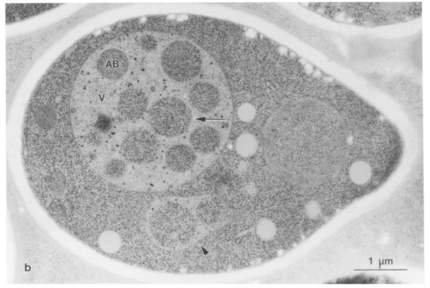
まず大隅先生は、電子顕微鏡が得意な馬場美鈴氏と協力し、酵母のなかで起こるオートファジーを電子顕微鏡写真で撮影しました。酵母のなかには液胞という大きなプールのような部分(下図矢印が含まれる灰色の大きな丸)が存在し、オートファジーによってできあがる袋状の構造「オートファジックボディ(下図矢印)」を観察することができました(※1)。
つづいて、オートファジーの仕組みの研究に移ります。仕組みを調べるには、オートファジーが起きない酵母を見つけることが近道です。なぜなら、オートファジーが起きる酵母と起きない酵母の違いを比べることで、オートファジーに必要なものが分かるからです。

たとえば、「沈さんは、めがねが無いと、よく見えない」と分かれば、「沈さんがモノを見るためにはメガネが必要」と分かりますよね。
ただ、これが大変なんですよ~(苦笑)
オートファジーが起こらない酵母をつくるためには、細胞の設計図であるDNAに傷をつけてやります。この傷はDNAにランダムに入ります。そして、DNAに傷が入った酵母の中から「オートファジーに関わる部分(遺伝子)に傷が入っていて、その他の部分には傷が入っていない」酵母を探さないといけないわけです。DNAのなかには、生きるために必要な遺伝子がたくさん並んでいます(その数、約6000!)。
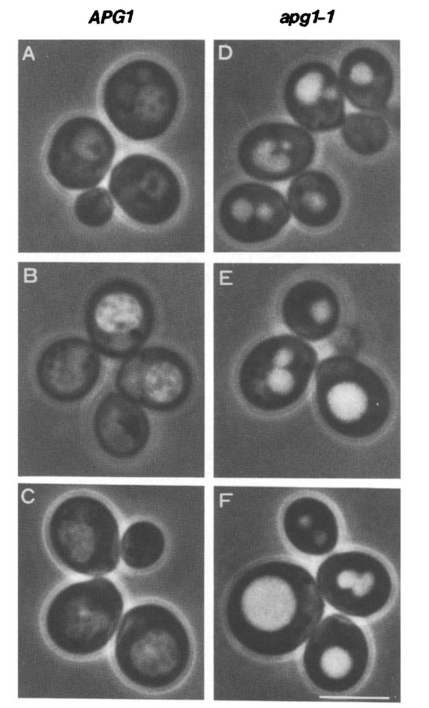
大隅先生と当時大学院生であった塚田美樹氏の2人は、化学薬品でDNAに傷をつけた酵母がオートファジーを起こすのか、ひたすら顕微鏡で観察しました。その数、なんと5000株!気の遠くなる個数ですね...。
そして、奇跡的にもたった1株だけオートファジーが行われない酵母を見つけることができました(もし見つからなかったら、どんなに落ち込んだことでしょう...)。
そして、DNAに傷がついた部分(遺伝子)を調べ、その遺伝子をapg1と名付けました。これが、20年以上に渡るオートファジー研究の始まりだったのです。昨年受賞された大村智先生もそうですが、素晴らしい研究の第一歩は、実に地道な研究なのですね...。
その後、オートファジーに関係する遺伝子を見つける方法を洗練し、DNAに傷をつけた38,000株(!)の酵母から15個の遺伝子を発見することができました(微生物学を専攻した志水にとっては、洗練された方法でも38,000株はものすごーく大変な数です。これを大隅先生と塚田氏の2人だけでほとんどやったなんて...)。
その後、大隅先生が発見した遺伝子は、動物細胞でも同じような働きを示すことが明らかになり、動物細胞のなかでオートファジーがどのような役割を果たしているのか、研究が急速に進みました。
例えば、大隅先生とともに研究を行った水島昇先生(現・東京大学教授)は、生まれたばかりのマウスの赤ちゃんが、母乳から栄養をとるまでの間、体の中で必要な栄養をつくりだすことに重要な役割をしていることを明らかにしました。その他にも、パーキンソン病のような脳神経系の病気などにも関係していると考えられています。
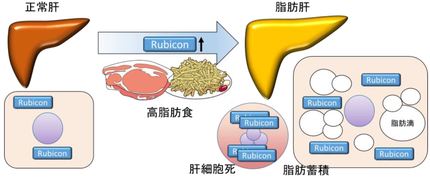
今年の9月には、大阪大学の吉森保教授らのグループが、オートファジーを抑制するタンパク質「Rubicon(ルビコン)」が脂肪肝・肝障害の発症に関わっていることを報告し、治療薬への応用も期待されているのです。吉森先生も、以前に大隅先生の研究室にいた方です。
大隅先生は、受賞後の会見で「基礎科学を見守ってくれるような社会であってほしい」とおっしゃっていました。大隅先生のご研究は、なかなか注目されなかった「モノを壊す」という基本的な働きを明らかにしたものです。大隅先生は、現在もオートファジーの仕組みの基礎的な研究で世界をリードし続けています。
最後に、大隅先生の孫弟子(水島昇先生の研究室で助教をなさっています)、久万亜紀子先生が未来館のトークイベント「サイエンティスト・クエスト」にご登壇いただいたときのお話をご紹介しましょう。
久万先生が持ってきてくださったのは、分子生物学を学ぶ人なら誰もが読む教科書「細胞の分子生物学(第5版、ニュートンプレス)」。

分厚い教科書のなかで、オートファジーに関する記述はわずか数行です。

久万先生は「この分厚い教科書のわずか数行の記述は、たくさんの研究者の努力によって支えられているところにロマンを感じる」とおっしゃっていました。
今年のノーベル賞は、そんな基礎的で地道な研究、でも私たちの健康をこれから支えてくれるであろう研究に贈られました。
【参考文献】
※1:Takeshige, K., Baba, M., Tsuboi, S., Noda, T. and Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
※2:Tsukada, M. and Ohsumi, Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cervisiae. FEBS Letters 333, 169-174
※3:「細胞が自分を食べるオートファジーの謎」(水島昇著、PHPサイエンス・ワールド新書、2011年)







